世界医疗器械(欧盟部分)法规培训
根据上海市人力资源和社会保障局《关于2019年上海市专业技术人才知识更新工程第一批项目的通知》,“世界医疗器械法规(欧盟部分)中国企业适用性培训”高级研修项目拟定于 2019年10月30日至11月1日在上海举办。
培训班为官方公益培训,旨在通过对欧盟医疗器械法规监管体系、欧盟医疗器械新法规MDR、新法规下各个关键点的新要求等的解读,使得企业对欧盟医疗器械法规体系、对于MDR的过渡期及欧盟医疗器械法规的全新内容和要求获得更加清晰的了解,以评估潜在企业合规问题,制定解决潜在问题的计划,尽快适应法规的更改及变化。
时间:2019年10月30日-11月1日
地点:上海市长江路43号
主办:上海理工大学国家级专业技术人员继续教育基地、上海理工大学医疗器械与食品学院、上海介入医疗器械工程技术研究中心
协办:中城Comp@ss、绿字(上海)信息科技有限公司(ITTN上海中心)、北京健康促进会
亮点:
培训学时计入专业技术人员继续教育学时
研修人员修完规定课程、经考核合格后可获得由国家级专业技术人员继续教育基地颁发的《上海市知识更新工程培训证书》
培训免费,学员往返交通费自理,培训班提供当地食宿安排
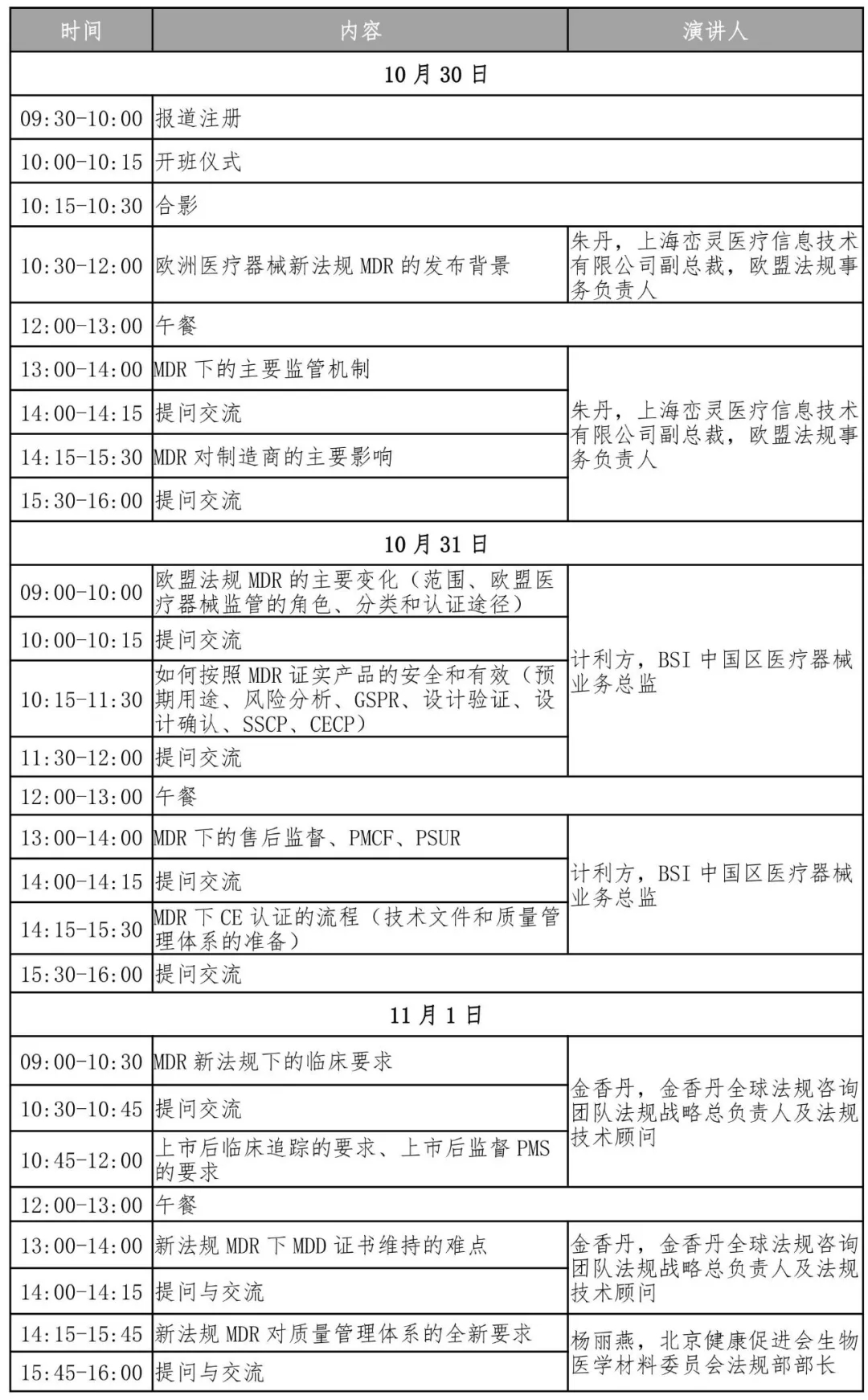
日程安排
培训对象:
医疗器械企业管理人员
具备一定医疗器械质量管理体系经验的人员
医疗器械企业海外注册经理及RA专员
医疗器械企业临床专员CR
医疗器械企业研发、技术、市场等与产品生命周期相关人员
讲师介绍:
计利方
BSI中国区医疗器械业务总监。计利方已经在BSI工作十六年,他在BSI担任过质量管理体系高级审核员、高级讲师、欧盟公告机构CE认证项目经理及产品评审专家等职务。计利方已经为数百家医疗器械公司提供过过千次现场审核,技术文件评审和培训服务,培训课程包括IRCA ISO13485主任审核员课程,ISO14971风险管理、 MDD指令、临床评估、售后监督及警戒系统、技术文件评审、单一审核方案MDSAP和欧盟新法规MDR & IVDR等课程。
金香丹
金香丹全球法规咨询团队法规战略总负责人及法规技术顾问。从事医疗器械行业14年,专注于医疗器械CFDA注册,CE,FDA,KFDA等海外注册、认证和咨询工作,产品类别涉猎广泛,以无源高风险植入类产品及其配件类产品、体外诊断试剂类产品为主。她具备14年的医疗器械生产质量管理经验,以及医疗器械认证注册经验,主要擅长于各个国家或地区的合规性、风险在临床中的应用及质量体系的有效管理。结合本专业优势,从风险受益角度分析和评价临床数据,从而证明产品的安全有效性。8年内共计编写100多个产品的临床评价报告及上市后临床试验方案的编写,在各国或地区的通过率达到100%。
杨丽燕
北京健康促进会生物医学材料委员会法规部部长,医药工程师。从事医疗行业30余年,专注于医疗器械企业质量管理体系审核、CFDA注册和相关培训工作。参与多家医疗器械企业质量管理体系建立及认证工作,在生产质量管理方面具备丰富的实践经验。
朱丹
上海峦灵医疗信息技术有限公司副总裁,欧盟法规事务负责人。朱丹有着十六年以上的医疗器械制造业及公告机构工作经验。曾任德国莱茵TÜV的MDD发证官,ISO 13485发证官,及全球TCC(Technical Competence Center)小组成员;作为德国莱茵TÜV授权的主任审核员,实施MDD、 IVDD、 ISO 13485、MDSAP、ISO 13485 under CMDCAS、Ordinance 169 under PAL等审核工作,完成近千个审核项目。




